Luego de haber analizado la corrosión y sus formas, es momento de ver qué
conocimientos se tienen hoy en día para prevenirla.
Antes de ver un análisis un tanto más profundo a las formas de proteger sobre
la corrosión, hablaremos un poco sobre la Protección Catódica y la Protección
Anódica.
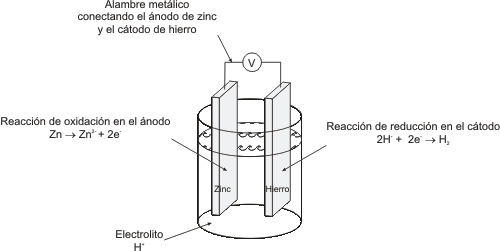
La PROTECCIÓN CATÓDICA ocurre cuando un metal es
forzado a ser el cátodo de la celda corrosiva adhiriéndole (acoplándolo o recubriéndolo)
de un metal que se corroa más fácilmente que él, de forma tal que esa capa
recubridora de metal se corroa antes que el metal que está siendo protegido
y así se evite la reacción corrosiva. Una forma conocida de Protección Catódica
es la GALVANIZACIÓN, que consiste en cubrir un metal con Zinc para que éste
se corroa primero. Lo que se hace es convertir al Zinc en un ÁNODO
DE SACRIFICIO , porque él ha de corroerse antes que la pieza
metálica protegida.
 |
| Protección catódica en las tuberias |
Por otro lado, la PROTECCIÓN ANÓDICA es un método
similar que consiste en recubrir el metal con una fina capa de óxido para que
no se corroa. Existen metales como el Aluminio que al contacto con el aire
son capaces de generar espontáneamente esta capa de óxido y por lo tanto, se
hacen resistentes a la corrosión. Aún así, la capa de óxido que recubre al
metal no puede ser cualquiera. Tiene que ser adherente y muy firme, ya que
de lo contrario no serviría para nada. Por ejemplo, el óxido de hierro no es
capaz de proteger al hierro, porque no se adquiere a él en la forma requerida.
Selección de materiales
La selección de los materiales que vayamos a usar será factor decisivo en
el control de la corrosión a continuación se enunciaran algunas reglas generales
para la selección de materiales:
- Para condiciones no oxidantes o reductoras tales como ácidos y soluciones acuosas libres de aire, se utilizan frecuentemente aleaciones de Ni y Cr.
- Para condiciones oxidantes se usan aleaciones que contengan Cr.
- Para condiciones altamente oxidantes se aconseja la utilización de Ti y
- Los elementos cerámicos poseen buena resistencia a la corrosión y a las altas temperaturas pero son quebradizos, su utilización se restringe a procesos que no incluyan riesgos.
Recubrimientos
Recubrimientos metálicos
Los recubrimientos se aplican mediante capas finas que separen el ambiente
corrosivo del metal, es decir que puedan servir como ánodos sacrificables que
puedan ser corroídos en lugar del metal subyacente. Los galvanizados son un
buen ejemplo de este caso. Un recubrimiento continuo de zinc y estaño aísla
el acero respecto al electrolito. A veces se presentan fallas con estos metales,
cuando el riesgo de corrosión es muy elevado se recomienda hacer un recubrimiento
con Alclad.
El Alclad es un producto forjado, compuesto formado por un núcleo de una aleación
de aluminio y que tiene en una o dos superficies un recubrimiento de aluminio
o aleación de aluminio que es anódico al núcleo y por lo tanto protege electroquímicamente
al núcleo contra la corrosión.
Recubrimientos inorgánicos
En algunos casos es necesario hacer recubrimientos con material inorgánico,
los mas usados son el vidrio y los cerámicos, estos recubrimientos proporcionan
acabados tersos y duraderos. Aunque si se expone un pequeño lugar anódico se
experimenta una corrosión rápida pero fácil de localizar.
Recubrimientos orgánicos
El uso de pinturas, lacas, barnices y muchos materiales orgánicos poliméricos
han dado muy buen resultado como protección contra la corrosión. Estos materiales
proveen barreras finas tenaces y duraderas para proteger el sustrato metálico
de medios corrosivos. El uso de capas orgánicas protege mas el metal de la
corrosión que muchos otros métodos. Aunque debe escogerse muy bien, ya que
hay procesos que incluyen tratamientos con alcoholes que en algún momento pueden
disolver los materiales orgánicos.
Diseño
Este quizá el método más efectivo para el control de la corrosión, ya que
si hacemos un buen diseño y una buena planeación podemos evitar dicho fenómeno,
a continuación se enumeraran algunas reglas generales que se deben seguir:
- Se debe tener en cuenta la acción penetrante de la corrosión junto con los requerimientos de la fuerza mecánica cuando se considere el espesor del metal utilizado. Esto se utiliza para tuberías y tanques que contengan líquidos.
- Son preferibles los recipientes soldados que los remachados para reducir la corrosión por grieta
- Se deben usar preferiblemente metales galvánicamente similares para prevenir para prevenir la corrosión galvánica. Si se atornillan metales no similares galvánicamente se deben usar arandelas no metálicas para eliminar contactos eléctricos entre los materiales.
- Es preciso evitar tensión excesiva y concentraciones de tensión en entornos corrosivos, para prevenir la ruptura por corrosión por esfuerzos, especialmente en aceros inoxidables, latones y otros materiales susceptibles a este tipo de corrosión.
- Se deben evitar recodos agudos en sistemas de tuberías por donde circulan fluidos. En estas áreas donde cambia la dirección del fluido bruscamente se potencia la corrosión por erosión.
- Se deben diseñar los tanques y recipientes de una manera que sean fáciles de limpiar y desaguar, ya que el estancamiento de sustancias corrosivas provoca la aparición de celdas por concentración.
- Se debe hacer un diseño eficiente de aquellas piezas que se espera queden inservibles en poco tiempo, para que sean fáciles de reemplazar.
- Es importante también diseñar sistemas de calefacción que no den lugar a zonas puntuales calientes, los cambios de calor ocasionan corrosión.
Alteración por el entorno
Las condiciones ambientales son muy importantes para el control de corrosión,
algunos métodos usados son:
- Bajando la temperatura se consigue disminuir la velocidad de reacción, por ende se disminuye el riego de corrosión.
- Disminuyendo la velocidad de un fluido corrosivo se reduce la corrosión por erosión. Sin embargo, para metales y aleaciones que se pasivan, es más importante evitar las disoluciones estancadas.
- Eliminar el oxigeno de las soluciones acuosas reduce la corrosión especialmente en las calderas de agua.
- La reducción de la concentración de iones corrosivos en una solución que esta corroyendo un metal puede hacer que disminuya la velocidad de corrosión, se utiliza principalmente en aceros inoxidables.
- La adición de inhibidores que son principalmente catalizadores de retardo disminuye las probabilidades de corrosión. Los inhibidores son de varios tipos: los inhibidores de absorción que forman una película protectora, los inhibidores barrenderos que eliminan oxigeno. En general, los inhibidores son agentes químicos, añadidos a la solución de electrolito, emigran preferentemente hacia la superficie del ánodo o del cátodo y producen una polarización por concentración o por resistencia.